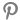IgA신병증은 국내 일차성 사구체질환 중 가장 많은 수를 차지하는 만성 사구체신염이다. Renin-angiotensin system (RAS) inhibitor를 포함한 비면역억제제 표준 치료를 충분히 시행함에도 불구하고 24시간 요 단백이 1g 이상인 경우 스테로이드와 같은 약제로 면역억제치료를 시행하는 것이 IgA신병증의 치료 원칙으로 널리 알려져 있다.
최근 IgA신병증 환자들에게 고용량의 RAS inhibitor를 적극적으로 사용하는 추세에 맞추어, 면역억제제 투여 전 run-in period로써 충분히 RAS inhibitor 치료가 된 IgA신병증 환자들을 대상으로 시행한 새로운 스테로이드 비교 임상 연구들이 진행되었다. 이들이 2015년 STOP-IgAN 연구와 2017년 TESTING 연구, 그리고 2022년 발표된 TESTING-2 연구이다.
이 중 TESTING 연구는 methylprednisolone 0.6-0.8 mg/kg/day를 투여한 136명의 시험군에서 심각한 부작용의 빈도가 28건 (위약군 5건), 감염 관련 사망 2건을 포함한 심각한 감염 발생이 시험군에서 11건 (위약군 0건) 발생하여 모니터링 위원회에 의해 조기 종결된 임상 시험이다[1].
TESTING 연구 이후 이에 고용량 스테로이드 투약군 외에 methylprednisolone 0.4 mg/kg/day의 저용량 투약군을 추가하고 예방화학요법을 치료 초기 3개월간 시행한 TESTING-2 연구가 시행되었다. 하지만 TESTING-2 연구에서도 심각한 부작용이 위약군에 비해 37건 대 8건으로 유의하게 높게 발생하였으며, 이로 인해 연구가 14개월 간 중지되기도 하였다. 감량 투약군에서 주요신장결과를 좋게 하는 효과가 관찰되었지만, IgA신병증 환자에서 스테로이드 치료의 효과 대비 부작용에 대한 논란은 지금도 지속되고 있다[2].
IgA신병증은 galactose-deficient IgA1 (Gd-IgA1)의 생성 증가와 Gd-IgA1에 대한 자가항체 형성, 이후 면역복합체 및 세포 독성, 메산지움 침착의 과정을 통해 발생한다. Gd-IgA1 생성 소인을 가진 환자에서 점막면역에 의해 IgA 항체 및 자가항체 생성이 시작된다. 경구로 복용하여 회장의 Payer’s patch에서 림프계로 흡수되어 점막면역을 선택적으로 저해하는 스테로이드 약제인 targeted-release formulation(TRF-budenoside)가 개발되었다.
IgA신병증 환자에서 TRF-budesonide의 효과를 확인하는 2상 임상 시험인 NEFIGAN의 연구 결과가 2017년에 발표되었다. NEFIGAN 연구에서는 9개월 동안 16 mg/day, 8 mg/day의 TRF-budesonide 치료군과 위약군을 사구체여과율 45 ml/min/1.73 m2 이상, 요 단백 0.75 g/day 이상의 IgA신병증 환자에서 무작위 배정하였다.
세 군에 배정된 환자수는 51명씩이었고, 9개월 치료 종료 시점의 1차 결과는 기저 대비 요 단백의 변화였다. 16 mg/day 군에서는 -27.3%, 8 mg/day 군에서 -21.5%의 변화를 보여 +2.7%의 변화를 보인 위약군에 비해 유의한 요 단백 감소 효과를 보였다.
전체 부작용 발생 비율은 16 mg/day 군에서 43명, 8 mg/day 군에서 48명, 위약군에서 42명으로 비슷한 수준이었고, TRF-budesonide 군에서 발생한 심부정맥혈전증 1건과 급성 신손상 1건 외에는 약제로 인한 심각한 부작용은 관찰되지 않았다. 심각한 감염도 발생하지 않은 것으로 보고하였다[3].
3상 임상 시험인 NeflgArd 연구에서는 9개월의 TRF-budesonide 16 mg/day 투여와 위약군을 비교하였다. 대상이 된 IgA신병증 환자는 사구체여과율 90-35 ml/min/1.73 m2 이면서 24시간 단백뇨 1.0 g 이상이었다. 각 군에 배정된 환자수는 153명씩이였고, 효과 및 부작용 분석을 시행한 대상 환자는 치료군 97명과 위약군 102명이었다.
1차 결과는 치료 종료 시점의 대조군 대비 요 단백 변화였고 추가로 치료 종료 후 3개월 뒤 사구체여과율을 추적관찰하였다. 치료군의 위약군 대비 9개월째 요 단백 변화 차이는 -27%였고 사구체여과율 변화율은 치료군에서 -0.17 ml/min/1.73 m2, 위약군에서 -4.04 ml/min/1.73 m2였다.
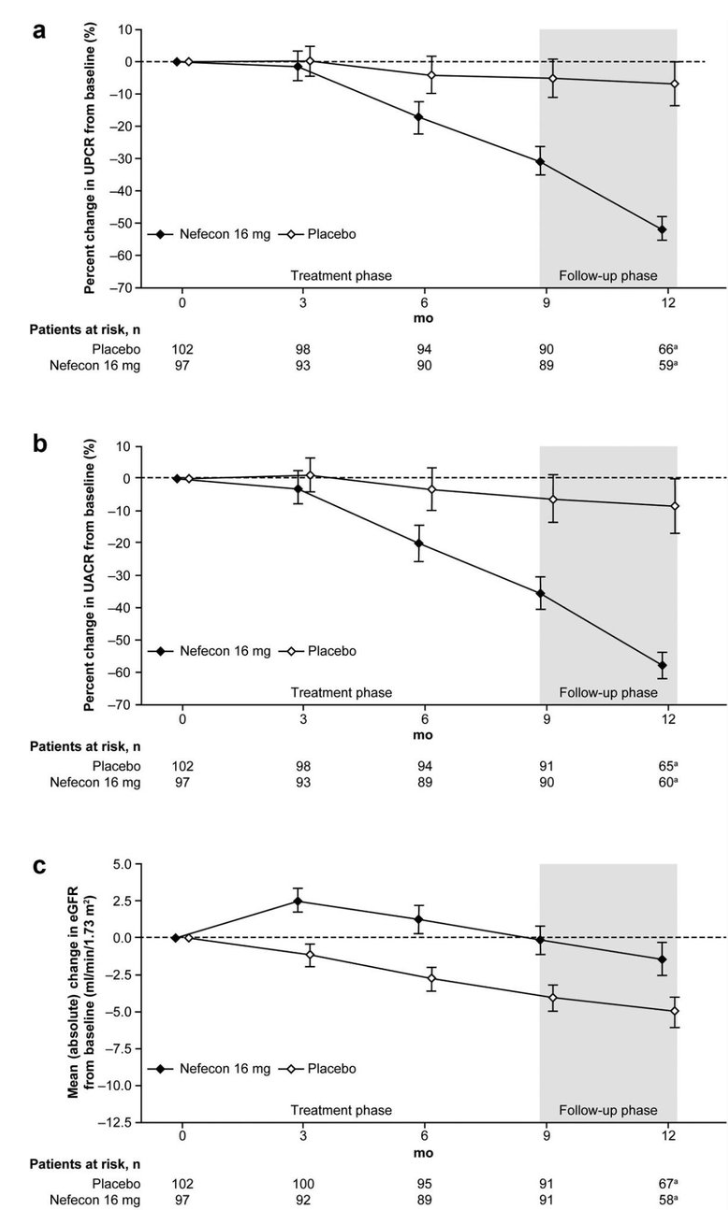
12개월째에도 요 단백 차이와 사구체여과율 변화율의 유의한 차이가 유지되었다 (그림). 전체 부작용 발생 비율은 치료군에서 86.6%, 위약군에서 73.0%였으며 감염 발생 비율은 치료군 39.2%, 위약군 41.0%였다. 입원이 필요하거나 사망에 이르는 심각한 감염 부작용은 양 군 모두 발생하지 않았다. 치료군에서 발생한 약물 유발 부작용에는 고혈압, 말초 부종, 근육 경련, 여드름 등이 있었다[4].
지금까지 살펴본 바와 같이 TRF-budesonide는 NEFIGAN과 NeflgArd 연구에서 요 단백 감소화 사구체여과율 보존에 효과를 보였고, 부작용 빈도나 심각한 부작용 발생을 높이지 않는 것으로 확인되었다.
하지만 아직 추가적인 확인이 필요한 부분이 많다. 우선 주요신장결과, 사망률과 같은 주요 지표에 대해 효과를 입증하는 것이 필요하다. 특히 TRF-budesonide와 스테로이드 치료의 효과를 대규모 임상 시험을 통해 직접 비교하여 주요신장결과에 대한 비열등성과 안정성을 증명하는 것이 필요할 것으로 생각된다.
이는 비용 문제와도 결부되는데, 한 비용-효과 분석 연구에 따르면 9개월의 표준 TRF-budesonide 치료를 받는데 드는 약제비는 미화 14,160 달러에 육박한다고 추산했다[5]. 표준 치료제인 스테로이드의 저렴한 가격을 고려하면, 고비용에 의한 치료 접근성 제한이 실제 임상현장에서 문제가 될 것으로 예상된다.
마지막으로 생각해볼 점은 IgA신병증 환자에서 새로운 비면역억제 치료로서 SGLT2 inhibitor가 부상하고 있다는 점이다. EMPA-KIDNEY, DAPA-CKD와 같은 대규모 임상 연구에서 SGLT2 inhibitor는 IgA신병증 환자의 주요신장결과와 단백뇨 감소에 뚜렷한 효과를 보인 바 있다. 따라서 향후 IgA신병증 환자에서 표준 치료로서 SGLT2 inhibitor 투여가 편입될 가능성이 높을 것으로 예상되고, 실제 임상에서도 SGLT2 inhibitor를 당뇨병이 없는 IgA신병증 환자에게 처방하는 사례가 많이 있다.
초기 IgA신병증 임상 시험이 Pozzi 등과 Manno 등에 의해 시행되었을 때 RAS inhibition를 충분히 시행하지 않은 것이 비판의 대상이 되었듯이, 앞으로의 IgA신병증 임상 시험도 SGLT2 inhibitor라는 새로운 변수를 대입하여 다시 시행해야 할 수도 있으리라 생각한다.


[저작권자ⓒ 대한신장학회 소식지. 무단전재-재배포 금지]