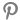IgA 신병증은 사구체신염의 원인 중 가장 흔한 질환으로 혈뇨와 단백뇨를 주 증상으로 하며 조직검사를 시행한 일차성 사구체신염 중 36% 정도를 차지하고 있다 [1].
IgA 신병증에서 단백뇨는 신기능 악화의 위험인자로 가장 최근의 KDIGO Guideline Public Review Draft (2024)에서는 IgA 신병증 환자에서 단백뇨를 0.5 g/day, 가능하다면 0.3 g/day까지 감소시켜 유지하도록 치료를 권고하였다. 또한 IgA 신병증에서 pathogenic IgA 생성을 저해하기 위한 치료로 Nefecon을 투약하는 것을 grade 2B의 수준으로 권고하였다.
이전 가이드라인에서 전신 스테로이드 치료를 권고하였던 것과 다르게 Nefecon을 사용할 수 없는 환경(“settings where Nefecon is not available”)에서만 전신 치료를 권고하고 있어 향후 IgA 신병증의 치료에 중요한 역할을 할 것으로 예상되는 Nefecon을 소개하고자 한다.
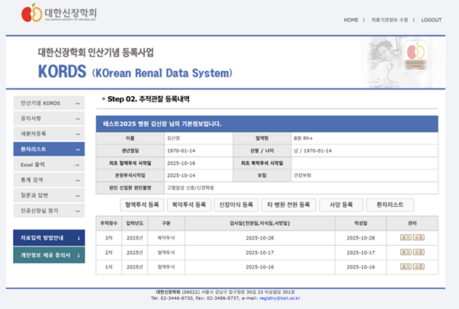
Nefecon은 표적방출형 budesonide로써 경구 복용하여 distal ileum까지 도달 후 분해되어 작용하며 장내에 존재하는 gut-associated lymphoid tissue (GALT)에 작용하여 병적인 IgA 단백이 생성되는 것을 저해한다.
IgA 신병증에서 galactose-deficient IgA1 (Gd-IgA1) 항체를 대부분 생성하는 점막 B 세포, 특히 Peyer’s patch에 있는 세포의 스테로이드 수용체를 통해 흡수되며 세포 내로 이동한 후 B 세포의 숫자와 활동을 조절한다고 알려져 있다 [2].
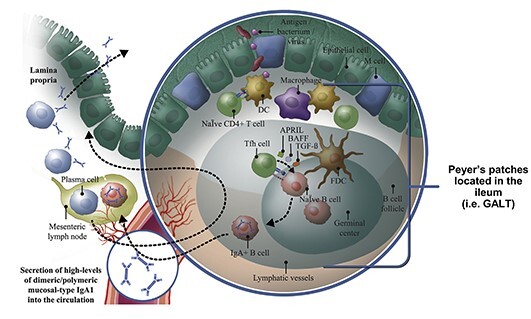
Budesonide는 장내에서 흡수된 후 거의 대부분이 간에서 first pass metabolism을 통해 대사되어 국소적인 면역조절효과를 보이면서 스테로이드 투여로 인한 전신 부작용을 최소화할 수 있다.
임상 2상 시험인 NEFIGAN (NCT01738035)은 18세 이상의 조직검사로 진단된 IgA 신병증환자 중 RAS blockade 시행에도 불구하고 지속적으로 0.75-1.0 g/day 이상의 단백뇨가 확인된 환자를 대상으로 하였다.
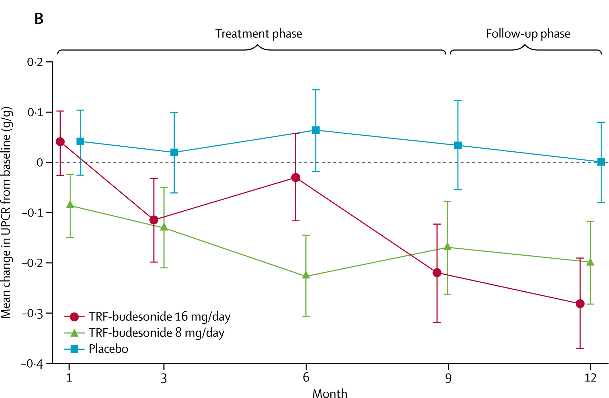
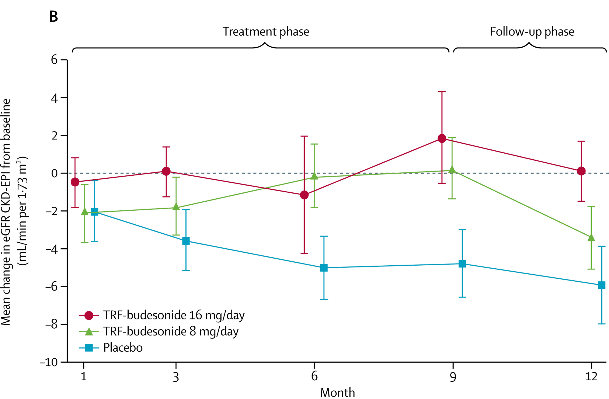
환자들은 Nefecon 16 mg, 8 mg, 혹은 위약군에 1:1:1로 배정되어 9개월간 투약을 진행하였으며 투여 종료 후 3개월까지 추적관찰을 시행하였다. 연구 종료 시 Nefecon 16 mg을 투약 받았던 환자군은 위약군에 비해 27-29%의 요단백-크레아티닌비 (UPCR)의 감소를 보였으며 Nefecon을 투약했던 환자들은 용량에 상관없이 위약을 투여받은 환자들보다 신기능이 보존되어 있음이 확인되었다 [3].
임상 3상 시험인 NeflgArd (NCT03643965)에서는 Nefecon 투여가 단백뇨를 감소시킴으로써 신기능 감소를 늦출 수 있다는 사실을 입증하였다.
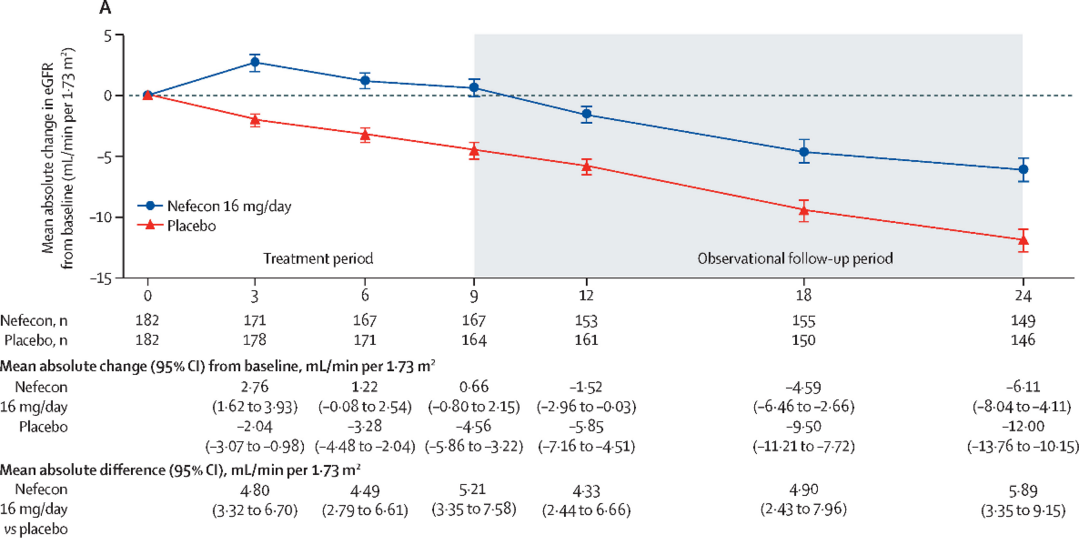
해당 연구는 eGFR 35-90 mL/min/1.73 m2의 신기능을 가진 일차성 IgA 신병증 성인 환자 364명을 대상으로 시행하였으며 optimized RAS blockade를 시행한 이후에도 UPCR 0.8 g/g 혹은 24시간 소변에서 1 g 이상의 단백뇨를 보인 환자들을 포함하였다. 다른 사구체신염이 동반되어 있거나 신증후군을 보인 환자들은 제외되었으며 이전 전신 스테로이드 치료를 받았던 환자들도 제외되었다.
Baseline 데이터를 보면 평균 사구체여과율은 58 mL/min/1.73 m2이었으며 60%의 환자들은 eGFR이 60 mL/min/1.73 m2 미만이었다. 연구 참여 대상자 중 70%가 고혈압을 진단받았으며 7%가 당뇨를 진단받았다. 거의 대부분의 환자들 (98%)는 연구 참여 시 ACE inhibitor나 ARB를 복용 중이었으나 1% 미만의 환자들만 SGLT2 inhibitor를 복용하고 있었다.
연구 참여 대상자들은 Nefecon 16 mg군 혹은 위약군에 1:1로 배정되어 약물 투여군은 9개월간 Nefecon 16 mg을 투여 후 중단한 상태로 15개월을 투약 없이 관찰하였다. 2년간의 연구기간 종료 후 Nefecon을 투여받은 환자들은 위약을 투여받은 환자들에 비해 안정적인 신기능을 보였으며 time-weight average eGFR이 5.05 mL/min/1.73 m2 더 높았다 [4].
모든 환자들은 투약과 관련된 중대한 감염이나 사망 없이 투약을 종료하였으며 빈도 5% 이상의 비교적 흔한 부작용으로는 말초부종, 혈압 상승, 근육경련과 여드름이 있었다.
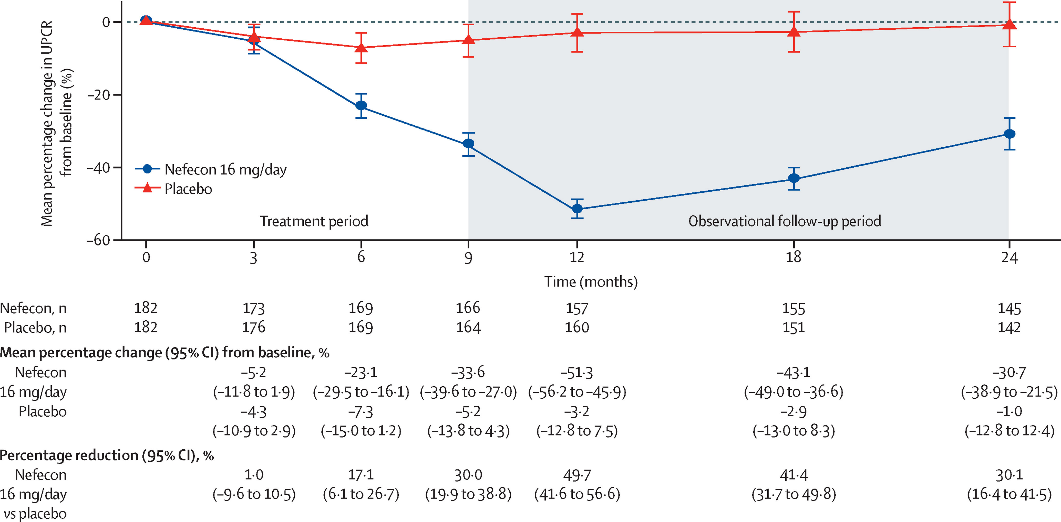
다만 Nefecon을 투여받은 환자군은 위약군에 비해 12개월에 UPCR이 최대치로 감소하며 baseline에 비해 약 51.3%의 단백뇨가 감소하는 추세를 보였으나 약물 중단 후 UPCR은 다시 증가하는 양상을 보였다 [4].
NeflgArd 연구가 종료된 환자들을 대상으로 이전 위약 혹은 Nefecon 투여 여부와 상관없이 NefIgArd 연구의 단백뇨와 eGFR 기준에 해당하는 환자 119명을 대상으로 Nefecon 하루 16 mg을 9개월 동안 투여하는 open-label extension 연구가 진행되었고, 포스터 발표가 있었다.
이중 45명이 NefIgArd 연구에서 Nefecon을 투여했었던 환자들이었고, 재투여나 첫 투여 모두 유사하게 단백뇨 감소와 eGFR의 변화가 있었다 [5]. 2차 Nefecon 치료 시에 효과는 있지만, 상당수 환자는 Nefecon 초치료 후 2년이 지나면 단백뇨가 다시 증가하는 것으로 보인다.
Nefecon은 TarpeyoTM라는 이름으로 2021년 12월 미국 FDA의 승인을 취득하였으며 최대 용량의 RAS blockade에도 불구하고 1.0 g/day 이상의 단백뇨가 지속되는 IgA 신병증 환자들을 대상으로 허가를 취득하였다.
Budesonide 혹은 캡슐의 구성성분에 대하여 과민반응을 보이는 환자, 진균 감염, 혹은 Child-Pugh C 이상의 간기능 장애가 있는 환자에서는 금기사항이며 약물 투여기간 동안에는 생백신 투여가 금지된다. 또한 CYP3A4 대사를 거치므로 CYP 억제제인 ketoconazole, itraconazole, clarithromycin, 자몽주스 등과 함께 복용하게 되면 독성이 증가할 수 있어 주의를 요한다.
Nefecon은 distal ileum의 pH에 반응하여 분해되므로 위산의 pH를 증가시키는 프로톤 펌프저해재나 제산제를 복용하는 것은 이론적으로 Nefecon 대사에 영향을 미치지 않는다.
Nefecon은 식전에 복용하여야 하며 약을 부수거나 씹지 말고 통째로 복용하여야 하며 9개월의 치료의 마지막 2주 동안은 하루 8 mg으로 용량을 감량한 후 tapering해서 복용을 중단하여야 한다. Nefecon 복용 기간 중에는 주기적으로 단백뇨, 사구체여과율과 혈압을 모니터링하도록 권고되며 빈도는 높지 않지만 스테로이드의 전신적인 부작용 여부도 확인하여야 한다.
IgA 신병증은 서양보다 동양의 발생 빈도가 높은 질환이며 NeflgArd 임상시험의 4명 중 1명이 동양인 환자였다는 점을 감안하였을 때 국내 IgA 신병증 환자들에게도 효과를 나타낼 수 있을 것으로 생각한다.
NefIgArd에 참여한 환자들과 Leicester General Hospital (LGH) registry 환자들을 eGFR, UPCR로 매칭하여 시행한 선형회귀모델 분석에서 Nefecon 투여는 투석을 12.8년까지 지연시킬 수 있는 것으로 밝혀져 IgA 신병증 환자들의 예후를 개선시킬 수 있는 약제가 될 수 있을 것으로 기대한다 [5].
다만, 네페콘에서도 발생할 수 있는 스테로이드 부작용, 치료 후 일정 기간이 지나면 다시 단백뇨가 증가하는 환자들의 향후 치료, 비급여 상태의 높은 약가 등이 실제 진료에 있어서 문제점으로 남아 있다.


[저작권자ⓒ 대한신장학회 소식지. 무단전재-재배포 금지]