단백질체학이란?
단백질체학(proteomics)은 세포, 조직, 체액 등에서 발현될 수 있거나 발현된 모든 단백질체에 관한 총체적인 연구 분야로 단백질 동정 및 발현량 측정뿐 아니라 단백질의 생체・세포 내 위치와 변화, 상호작용, 기능과 구조 분석을 포함하며 생명 활동과 직결되는 정보를 제공하기 때문에 기초 연구뿐만 아니라 다양한 형식의 진단 플랫폼 개발과 신약 개발 분야에서 강력한 학문적 근거로 사용되고 있다.
단백질체학의 핵심기술
단백질체학 기술은 크게 단백질 분석기술, 단백질 기능 규명 기술, 단백질체 정보기술로 나뉘며, 핵심기술인 단백질 분석기술은 단백체 분리 분획 기술과 질량분석을 이용한 단백질 동정 및 정량 기술이 주를 이룬다. 단백질 기능 규명 기술은 단백질 상호작용 및 경로 분석, 단백질 구조 규명 및 디자인, 세포 및 개체 기반 단백질 기능 검증 기술 등으로 구분되며, 단백질체 정보기술은 단백질체학적 과정에 있어 자료 분석 및 결과 해석에 기반이 된다.
단백질체학의 연구 방법
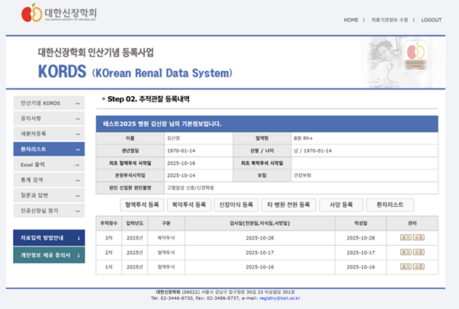
1) 시료의 종류와 단백체 분석을 위한 전처리
정량적 단백체 연구를 위해서는 100ul의 plasma나 serum과 새끼손톱 정도의 수술 조직이 필요하다. 최근에는 1ml의 spot urine과 내시경 biopsy 조직과 더불어 10㎛ 두께의 FFPE 조직 시료에 대해서도 단백체 분석이 가능하다.
PDX나 PDC에 대한 단백체 분석도 가능하며 최근 각광받고 있는 세포와 소체(Extracellular vesicle, Exosome)에 대한 단백체 분석도 활발하게 진행되고 있다. 단일세포를 분리하고 전처리하는 기법과 더불어 질량분석기의 민감도 개선에 따라 1개의 세포에서 3000여 개의 단백질을 정량분석할 수 있는 기술도 개발된 상태이다.
대략적으로는 위의 시료들로부터 적절한 파쇄와 detergent를 사용하여 단백질들을 추출하고 이를 trypsin을 이용하여 tryptic peptide를 제조한다. 이 tryptic peptide는 C 말단이 Arginine이나 Lysine으로 끝나게 되어 N 말단과 더불어 이온화 과정에서 protonation될 수 있는 아미노산으로 작용하게 된다.
연구 목적에 따라 Phosphopeptide 또는 Acetylated peptide들만 따로 enrich를 하여 분석을 할 수 있으며 Immunoprecipitation을 통해 target protein과 상호작용하는 단백질들만 따로 분석할 수 있다.
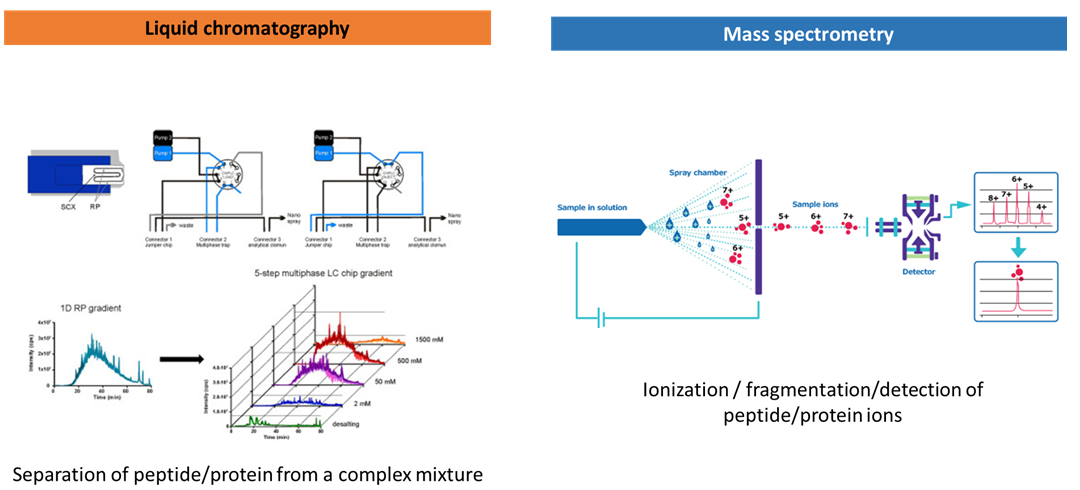
2) Liquid chromatography
복잡한 단백질 복합체에서 만들어진 peptide들은 더 높은 complexity를 가지게 된다. 이 complexity를 낮추기 위해 peptide들의 길이에 따른 hydrophobicity를 이용하여 C18 고정상과 유기용매의 이동상을 기반으로 한 reverse phase chromatography로 peptide를 분획하는 과정을 거친다.
이 LC 과정을 통해 복잡한 peptide 혼합물을 분리, 분획하고 on-line으로 바로 질량분석기의 ion source 부분으로 도입되어 peptide를 이온화하게 된다. 대부분의 LC는 250~300nl/min의 유속을 사용하여 내경 75~50um의 C18 컬럼을 통해 peptide를 분리하게 되고 Electrospray ionization (ESI)의 형식으로 peptide를 이온화시킨다.
3) Mass spectrometry
이온화된 peptide는 고진공 상태인 질량분석기에 들어가서 peptide ion의 질량대전하비(mass to charge ratio, 측정하고 고분해능 질량분석기는 이 m/z 값과 전하를 측정하여 mass를 계산하게 된다. 이를 MS1 scan (MS)이라고 하고 이후에 peptide ion을 전기적, 물리적인 방법으로 fragmentation을 시켜 fragment ion을 생성하고 이 fragment ion의 m/z와 전하를 측정하여 fragment ion들의 mass값을 계산한다. 이를 MS2 scan (MS/MS) 이라고 한다.
질량분석기는 LC에서 계속하여 유입되는 peptide를 이온화하고 이런 MS, MS/MS scan을 1초에 20번씩 진행하면서 Spectrum이라는 형식의 file을 생성하게 된다. 이 spectrum에는 MS1, MS2의 m/z, 용출 시간, intensity 정보가 포함되어 있다. 현재는 대부분의 MS analyzer를 Orbitrap 방식을 사용하고 Time of Flight (TOF), 또는 Quadrupole과 TOF가 결합한 형식인 Q-TOF 방식의 질량분석기가 사용되고 있다. 표적 단백질 정량 분석에는 Triple quadrupole (QQQ) MS가 주로 사용된다. 연구 목적에 맞는 질량분석기를 잘 선택하는 것도 매우 중요한 요소이다.
4) Sequence database search
Spectrum 정보와 database화된 proteome sequence 정보를 이용하여 peptide의 서열을 결정하고 이를 단백질의 정성 및 정량 정보로 convert 하는 과정이 필요하며 이 과정에서는 MASCOT, Sequest, Andrometa 처럼 다양한 알고리즘들이 활용되어 spectrum을 분석할 수 있다.
최근에는 무료로 사용할 수 있는 MaxQuant, MS Fragger라는 software를 사용할 수 있으며 QQQ MS data는 Skyline이라는 open source software를 사용할 수 있다 이 과정을 통해 단백질들의 정성, 정량 정보를 도출할 수 있으며 목적하는 Post-translational modification (PTM)의 정성, 정량 분석도 가능하다.
5) 통계 분석 및 pathway 분석
단백질들의 정량 및 정성 정보 결과는 해당 단백질들이 어떤 pathway와 관련되어 있는지를 분석하는 ontology 분석이 연구에 도움이 되는 경우가 많다.
Protein accession number를 이용하면 gene ontology 분석을 활용하여 biological process, cellular compartment 및 molecular function을 분석할 수 있다. 그리고 The Database for Annotation, Visualization and Integrated Discovery (DAVID,https://david.ncifcrf.gov/), ShinyGO (http://bioinformatics.sdstate.edu/go/) 또는 EnrichR (https://maayanlab.cloud/Enrichr/)이 활발하게 무료로 사용되고 있다.
유로로는 Qiagen Ingenuity pathway analysis (IPA)가 주로 단백체 분야에서 사용되고 있다. 통계 분석은 다른 오믹스 연구에서처럼 Volcano plot이나 다양한 dimension reduction analysis (PCA, PLS-DA)가 사용되며 multivariate analysis를 통한 classification 분석도 최근에는 많이 활용하여 panel을 구축하는 목적으로 적용되고 있다.
6) 정량적 단백체 분석
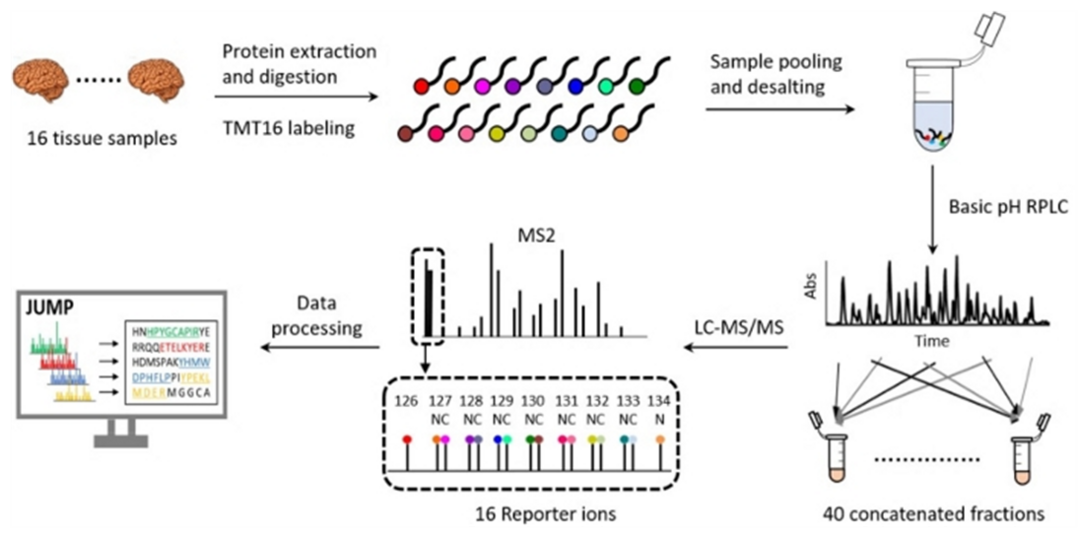
초기 이차원 전기영동에 기반을 둔 정량 기술보다는 최근에는 LC와 Mass spectrometry만 사용하여 분석이 이루어지고 있으며 안정 동위원소를 표지하는 방식(stable isotope labeling)과 비표지방식 (Label free quantitation, LFQ) 두 가지 방식이 있다. 시료 간의 상대적 양을 비교하는 상대 정량 기술에는 ICAT, iTRAQ, SILAC, IDBEST, TMT 등과 같은 표지식 방법이 주로 사용되며 Kit화된 방식으로 그 적용 사례가 증가하고 있다.
TMT(Tandem Mass Tag)의 경우에는 최대 16개의 서로 다른 시료에 대한 동시 분석이 가능한 16-plex TMT가 개발되었다. 비표지 상대 정량법은 peptide들의 상이한 이온화 효율, 존재량과 peak 세기 간의 비선형 관계, 데이터 처리 부분에서의 문제점을 개선하고 spectral counting을 이용한 emPAI, NASF 등과 extracted ion chromatogram 기반의 MaxLFQ, iBAQ 등의 알고리즘이 개발되어 다양한 정량분석에 활용되고 있다.
절대 정량기술에는 SISCAPA, QCAT proteotypic peptide, mTRAQ 기술 등이 사용되고 있으며, SIS(stable isotope standard)를 사용한 삼중-사중극자 기반 MRM (Multiple reaction monitoring) 기술 이용이 적용되고 있다. 최근 MRM에 비해 transition 선정 소요 시간이 짧은 PRM (Parallel reaction monitoring)과 재현성이 우수한 DIA (Data independent acquisition) 방법도 개발되었다.
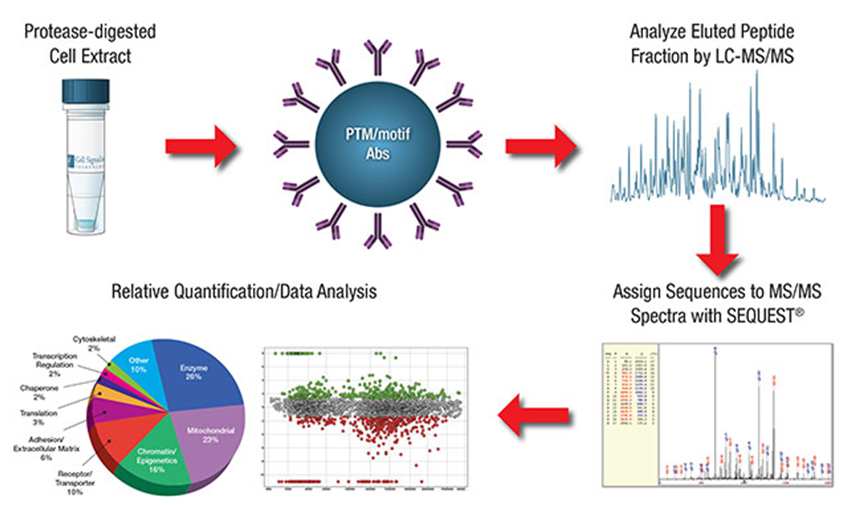
7) Post-translational (PTM) 단백체 분석
번역 후 단백질 변형에는 phosphorylation, Acetylation 및 ubiuqutiation 등 병리 기전에 핵심적으로 작용하는 PTM 들이 존재한다. 최근 단백체 분석에서는 각 PTM 된 단백질들만 immunoprecipitation이나 affinity chromatography로 enrichment 하여 분석할 수 있는 시료 전처리 kit들이 개발되어 end user들이 손쉽게 전처리할 수 있다.
Phosphoproteome은 최근 Cell Signalig Technology사가 개발한 PTM Scan kit를 사용하면 손쉽게 조직이나 세포주에서 각 pathway에 해당하는 인산회, 아세틸화 및 Ubiquitinated peptide들을 IP하여 전처리할 수 있다. 해당 PTM proteome은 정상적인 분석뿐만 아니라 정량적인 분석도 가능하여 신약 개발과 기전 연구 등 다양한 중개 연구에 활용할 수 있다.
맺으며
현재 단백체 분석 기법은 질량분석기의 분해능과 scan speed가 개선되고 LC의 performance가 좋아지면서 다양한 형태로 발전하고 있다. 고질적인 문제였던 Low throughputness는 하루에 최대 200개의 시료 분석이 가능한 상태이며 FFPE slide에서 Region of Interest (ROI)를 laser capture microdissection 하여 spatial한 정보를 포함한 조직 단백체를 분석하는 Spatial proteomics와 더불어 single cell proteomics도 분석이 가능한 상태이다. Cell 하나하나를 하나의 well로 분리하고 peptide를 제조하여 분석하는 분석법이 현재 구현되고 있으며 Single cell에서 약 1,300개의 단백질을 정량, 정성 분석할 수 있다.
끝으로 단백체 기법을 활용한 연구에서 가장 중요한 것은 연구 가설을 증명하기에 적합한 단백체 분석 기법과 시료를 적용하는 것이며 단백체 전문가와 상의하는 것이 필요하다 하겠다.


[저작권자ⓒ 대한신장학회 소식지. 무단전재-재배포 금지]