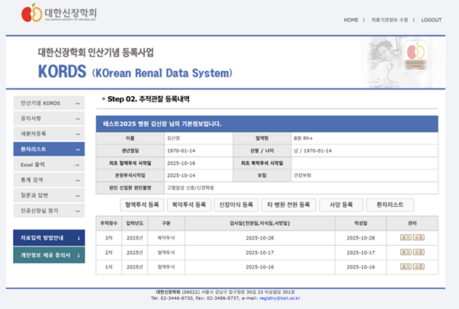
혈액은 인체 유래물 중 비교적 손쉽게 채취할 수 있고, 전신적인 질환의 활성도를 측정하거나 장기의 질환을 진단하거나 기능을 평가하는 데 매우 유용하기 때문에 가장 많이 사용되는 검체 중 하나이다. 혈청(Serum) 혹은 혈장(Plasma)은 비교적 검체 수득 및 보관이 간단한 데 반하여, 말초혈액 단핵구(Peripheral blood mononuclear cells, 이하 PBMCs)는, 혈액 채취 후 복잡한 세포 분리 과정이 필요하고, 보관도 비교적 까다롭다.
그러나, 본 검체를 잘 활용하면 훨씬 다양하고 영향력 있는 연구를 할 수 있는 장점이 있다. 본 방법론 소개에서는 환자의 혈액을 이용한 연구에 관심이 있는 선생님들의 이해를 돕고자, PBMCs를 이용한 다양한 연구 방법들에 대해서 소개하고자 한다 (그림 1).
1) 혈액 채취 후 PBMCs 분리 과정 및 보관
모든 검체가 그러하듯이 PBMCs를 이용한 연구의 시작은 양질의 검체를 채취하고 보관하는 것이다. 우선 환자 혈액에서 PBMCs를 이용하는 연구를 고려하고 있다면 채혈 시 헤파린 (heparin)으로 코팅된 튜브를 사용해야 하며, 연구를 수행하는데 충분한 세포를 확보하기 위해서는 최소 10mL의 혈액을 채취할 것을 권고한다. 환자의 상태에 따라 다르나 평균적으로 10mL의 혈액에서 5x10 6제곱 개 내외의 PBMCs 확보가 가능하다.
채혈 후에는 세포가 죽는 것을 방지하기 위해서 즉각적으로 세포 분리를 시행하는 것을 권고한다. 다양한 프로토콜이 존재하나, 본 연구실의 프로토콜에 의하면 순서는 다음과 같다. 50 mL conical tube에 Ficoll-Paque Plus 10mL을 준비하고, 또 다른 conical tube 에는 채혈된 혈액을 담는다.
혈액과 1xPBS를 1:1로 혼합 후 Ficoll-Paque Plus를 천천히 혈액 위에 띄워준다(섞이면 안됨). 이후 원심분리 (2000rpm, 20℃, 30min centrifuge) 하게 되면 4가지 층(Plasma층, 불투명 흰색의 얇은 Lymphocyte층, 투명한 ficoll층, 혈구층)으로 분리가 되며, buffy coat로 불리는 불투명 흰색의 얇은 층에 PBMCs가 존재한다. 이를 transfer pipet으로 새 50ml conical tube에 옮기고 1xPBS를 넣어준 후, 원심분리한다. 상층액을 버리고 다시 PBS로 세포를 풀어주는데, 이때 cell count를 반드시 해둬야 추후 실험에 사용할 세포 수를 간편이 파악할 수 있다.
실험을 바로 진행할 예정이 아니면, 10%FBS/DMSO cryo media로 cryo-tube에 분주 후(일반적으로 1~5x106 cells/tube), slow freezing container(iso-propanol)에 넣은 상태로 -80°C Deep Freezer에 24시간 보관 후, 장기간 보관을 위해서 질소 탱크에 옮겨 보관한다.
2) 유세포 분석 (Flow cytometry)을 이용한 면역세포 분석
확보된 PBMCs를 이용한 연구 중 가장 흔히 이용되는 연구가 유세포 분석 (Flow cytometry) 이다. 유세포 분석은 이미 임상에서 다양한 분야에 적용되어 사용되고 있으며, 기본적으로 측정하고자 하는 입자나 세포를 하나 하나씩 흐르는 유액 상태에서 광원으로 쓰여 지는 특정한 Laser와 부딪쳐서 발생하는 물리적인 현상(빛의 산란현상, 형광물질의 발광현상)을 이용하여 세포에 관련된 여러 가지 정보를 측정하는 방법이다 (그림 1).
유액 상태의 입자나 세포가 일정 감지 지역(sensing point)을 통과할 때 각각의 입자나 세포를 신속하게 측정하여 한 세포가 갖는 여러 특징(세포의 크기, 세포 내부 조성정도, 세포기능 인지 등)을 동시에 측정할 수 있으며, sorting 장비를 이용하여 특정한 세포들 만을 선택하여 분리 후 목적에 따라 연구에 활용할 수 있다. 유세포 분석은 기존의 면역 형광현미경 검색이나 면역효소 염색법에 비하여 민감도(sensitivity)와 정확도(specificity) 월등하고, 따라서 면역세포와 연관된 질환의 기능적 상태를 측정하고 질병의 추이를 관찰에 유용하고, 또한 결과가 숫자로 표현되어 객관성 있게 재현되는 장점이 있어, 유세포분석기의 발전과 함께 실험에서의 영역을 더욱 넓혀가고 있다.
3) 면역세포의 기능 평가
유세포 분석이 면역세포의 특성을 파악하는 데 유용한 연구방법이기는 기능적인 면을 파악하는 데에는 한계가 있다. 이식 영역에서 면역세포의 기능을 평가하는 대표적인 방법으로 Immuknow assay(Cylex, Inc.,Columbia, USA)와 ELISPOT(Enzyme-Linked ImmunoSpot) assay가 있다.
Immuknow assa는 CD4+ T세포의 기능 평가 목적으로 ATP를 측정하는 방법으로서 이식거부반응 혹은 감염의 위험도를 평가하는 데 유용하다. ELISPOT은 특정 항원에 대한 반응으로 T (혹은 B) 세포의 특정 사이토카인 생산을 정량적으로 측정하는 방법으로서, 신장이식 환자에서의 거부반응(공여자 항원 특이 ELISPOT) 혹은 BK 바이러스나 거대세포 바이러스에 대한 환자의 면역능을 평가하는 데 활용된다.
4) PBMC를 이용한 단일세포전사체 분석
단일세포 전사체 분석 (Single Cell RNA sequencing, 이하 scRNA seq)은 이전에 방법론에서 한차례 소개된 바 있는 연구기법으로서 신장 내과 영역에서는 환자 혹은 동물 실험에서 얻어진 콩팥 조직을 이용한 질환 규명 연구가 주로 이루어지고 있다. PBMCs를 이용한 scRNA seq 연구는 자가면역질환이나 종양 면역학 분야에서 주로 그 결과가 보고되고 있다. 더불어 신장 질환의 합병증 발생에 다양한 면역세포들의 활성화가 관여한다는 근거들이 제시됨에 따라, 신장질환자의 PBMCs를 이용한 연구도 최근 들어 보고되고 있다.
환자 혈액으로부터 분리한 bulk RNA를 이용한 microarray나 RNA sequencing기법으로 사구체 신염 혹은 신장 이식 환자에서 바이오 마커를 개발하는 연구는 오래전부터 지속되어 왔고, scRNA seq의 도입에 따라, PBMCs를 이용한 바이오 마커 개발 연구들이 한층 더 정밀한 방법으로 진행될 수 있을 것으로 기대된다.
5) 환자 유래 PBMC를 이용한 만능유도줄기세포 제작
2006년 일본 도쿄대의 야마나카(Yamanaka,S) 교수가 체세포의 역분화를 이용한 사람 유도만능줄기세포(Human induced pluripotent stem cells, 이하 hiPSCs), 혹은 역분화 줄기세포 제작법을 확립하였다. 초창기 역분화 줄기세포 제작에는 주로 사람의 피부에서 채취한 skin fibroblast가 사용되었다. 하지만 최근에는 지방조직세포(adipose tissue cells), 소변 세뇨관 상피 세포(Urine renal tubular epithelial cells), 그리고 본 방법론의 주제인 PBMCs를 이용해서도 hiPSC의 제작이 가능하다.
hiPSC의 제작 원리는 기본적으로 Yamanaka factor로 불리는 만능 유도능 전사체 (Oct-4, Sox-2, Klf4, c-Myc)들을 강제적으로 표현 시키는 데 있다. 이를 위해 virus vector, plasmid transfection, mRNA translation 등 다양한 방법들이 사용되고, 제작된 hiPSCs는 특징적인 colony 형성 및 만능분화능을 표현하고 있어야 한다 (그림 2).
본 연구실에서는 환자로부터 분리한 PBMC에 Sendai virus vector 를 처리하는 방식의 프로토콜을 사용하고 있고 (J Vis Exp 2016;118:e54650), 현재까지 거핵성 신염, 기틀만씨 병, 파브리병 등 다양한 유전성 신장 질환자 유래 hiPSC 주를 제작 및 뱅킹 하여 질환 모델링 및 기전 규명 연구에 사용하고 있다. 실험실에서 자체적인 hiPSC의 제작이 어려운 경우 ‘국가줄기세포은행’의 홈페이지에서 분양 가능한 줄기세포주를 확인 후, skin fibroblast, cord blood, PBMCs 유래 등 다양한 기원의 hiPSC를 무료 분양 받을 수 있다.
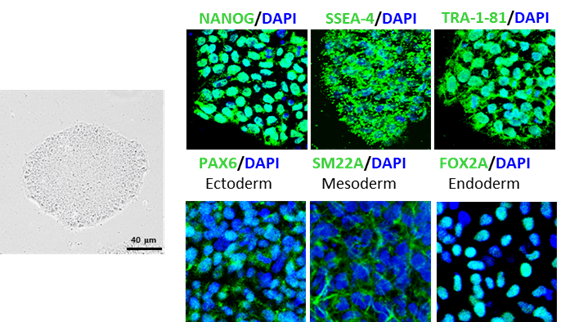
6) hiPSC를 이용한 오가노이드 제작 및 다양한 질환의 모델링
위에 기술한 hiPSC의 제작 방법의 발명은 다양한 표적 장기를 모사한 오가노이드(Organoids, ‘실제 장기의 구조와 기능을 일부 닮았다’는 의미로 실제 장기의 구조 및 기능 일부가 조직 또는 기관의 형태와 기능을 재현할 수 있는 작은 배양체를 의미한다) 제작을 가능케 했다. hiPSC를 이용한 콩팥 오가노이드 제작은 호주 멜버른 대학에서 세계 최초로 성공하였고, 이후, 여러 그룹에서 독자적인 프로토콜을 개발하여 콩팥 오가노이드 제작 연구를 수행하고 있다 (그림 3).
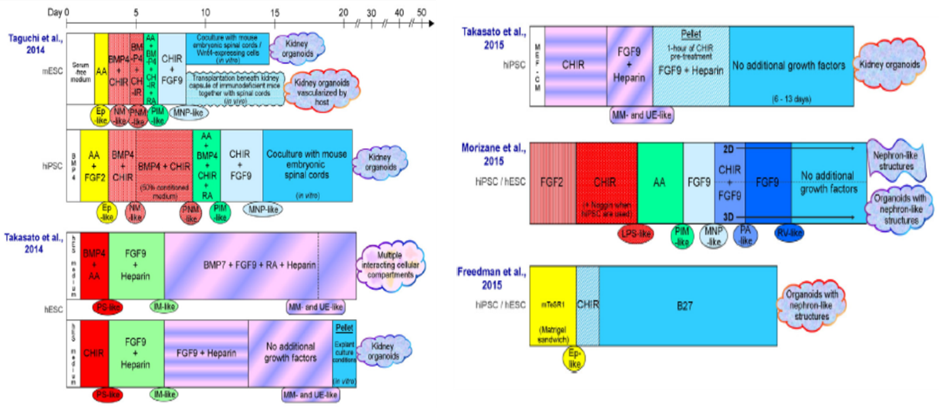
기본적인 콩팥 오가노이드 분화 프로토콜의 공통점은, 사람 콩팥 발생시 미세 환경에서 발생하는 생체내 신호를 모사하는 데 있으며, 배양중인 hiPSC에 GSK3β 및 FGF 신호 전달 경로를 조절하여 콩팥 오가노이드로 분화를 유도한다. 이렇게 분화된 콩팥 오가노이드는 인간 태아 네프론 (nephron, 신장단위)에 있는 도관, 세뇨관 및 사구체의 형태와 세분화된 구조를 재현한다 (그림 4).
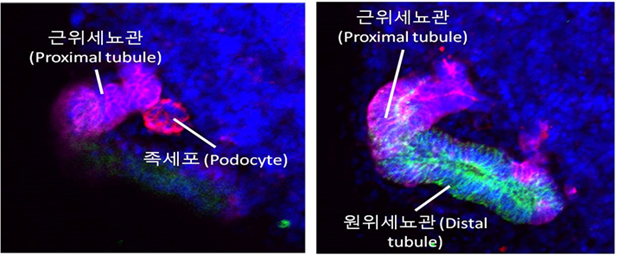
이러한 hiPSC와 오가노이드를 활용한 연구는 CRISPR/Cas9 유전자 편집 기술과 접목하여 그 활용도를 극대화 시킬 수 있다. hiPSC 상태에서 유전자 가위를 활용하여 질환과 연관된 특정 유전자를 편집할 수 있고, 이렇게 질환 유도된 hiPSC를 이용하여 콩팥을 포함한 표적 장기 오가노이드를 제작하면, 장기의 질환의 특성을 대변하는 오가노이드가 만들어진다.
또한 환자 유래 hiPSC를 이용하는 경우 제작된 hiPSC와 오가노이드는 환자가 보유한 유전적 이상을 그대로 보유하게 되므로, 역시 환자의 질환의 특징이 제작된 오가노이드에 반영되며, 이러한 방법을 이용하여, 환자 맞춤형 오가노이드 제작이 가능하다. 이러한 플랫폼은 유전질환의 모델링 및 신약 개발에 활용될 수 있고, 특히 환자 유래 오가노이드는 개인의 차이를 반영한 개인 맞춤형 약물 효과 검사를 가능하게 할 것이다. 이러한 오가노이드 연구는 제작 프로토콜이 점차 발전하고, 또한 표준화됨에 따라 보다 많은 영역에서 활발히 활용될 수 있을 것으로 기대된다.

[저작권자ⓒ 대한신장학회 소식지. 무단전재-재배포 금지]