인간 유도만능줄기세포(human induced pluripotent stem cells, hIPSC)에서 유래한 신장 오가노이드는 신장 질병, 신장 발생 및 재생 의학의 새로운 연구 플랫폼으로 각광받고 있다. 오가노이드는 동물실험과 달리 사람에게서부터 직접 얻어 구현되는 시스템인 만큼, 실험적으로 조작성이 높고, 빠른 시간안에 다량의 실험을 가능하게 하고, 조직 재생 연구에 획기적인 실험 플랫폼으로서의 장점을 갖는다.
1. 오가노이드의 정의
신장 오가노이드를 간략하게 정의하면 hIPSC 에서 파생된 “proximal nephron (근위 네프론)” 유사구조라고 할 수 있다. 이러한 신장 오가노이드는 생체 내 후신(metanephric) 중간엽에서 발견되는 네프론 전구 세포 (nephron progenitor cell)로부터 분화되는 산물과 유사한 상피 구조를 포함한다. 이들은 별도의 줄기세포 풀인 ureteric bud에서 파생되는 집합관을 자연적으로 생성하지 않는다. 오히려 ureteric bud는 상호 유도 작용을 통해 네프론 전구 세포 풀을 유지하고, 균형을 유지하여, branching 된 도관 네트워크의 형태를 생성한다. 신장 오가노이드 상피세포는 인접한 족세포, 근위세뇨관, 원위세뇨관로 구성되며, 이들 세포의 모양과 마커 역시 생체내와 동일하게 나타난다.
2. 오가노이드를 통한 신장 생리 연구의 장점
-종특이성 (Species specificity) : 오가노이드는 인간에서 직접 얻은 human genome sequence가 incoding된 유전자와 단백질을 발현하므로, 인간세포, 유전자 또는 단백질과 특이적으로 상호작용하는 분자 연구에 유리하다. 생체 내에서 직접 측정할 수 없는 실험 대상으로 할 수 있다.
- 재구성(reconstitution) : 오가노이드는 시험관 내에서 재구성할 수 있 기능 유형과 조건을 결정하는 데 사용될 수 있다. 완전히 구축된 사태로 도착한 모델 유기체에 비해 독특한 이점이다
- 유연성(Flexibility) : 자연계에서 발견되지 않거나 살아있는 유기체에 치명적일 수 있는 돌연변이를 포함하여 다양한 돌연변이를 생성하여, 유전자 편집의 대상으로 적용하여 실험할 수 있다.
- 실험적 접근성 (Experimental accessibility): 오가노이드는 저속촬영 사진을 통해 현미경을 통해 관찰이 용이하고, 배양배지에 물질을 추가하여 그 효과를 시각적으로 관찰할 수 있어, 원인에 따른 표현형의 변화를 밝히기 용이하며, 생체 내에서 직접 시행하기 어려운 실험도 가능하다.
- 확장성 (Scalability) : 소형화 및 자동화가 가능하며, 잠재적인 유전자 조작이 가능하다.
- 참신함(Novelty) :이전 플랫폼에서 시행할 수 없었던 다양한 접근을 가능하게 한다.
3. 생리학적으로 분석 가능한 오가노이드의 형태
신장 오가노이드의 상피 세포는 생리학 연구와 관련성이 높은 특정 특성을 가지고 있는데, 근위-원위 패터닝 외에도, 상피는 측면으로 정렬되고 쉽게 구별되는 정점 접합부 및 기저층에 의해 연결된 세포의 선형 배열을 포함하는 정점-기저 분극화 (apicobasal polarization)를 나타낸다. 신장 오가노이드는 선천적, 또는 후천적인 질환을 모사할 수 있는데, 예를 들어, 다낭신 환자에서 분화시킨 오가노이드에서는 세뇨관 팽창을 통해 형태학적으로 큰 낭종을 만들게 된다. 표2는 현재 많이 사용되고 있는 주요 생리학적 분석의 요약을 보여준다.
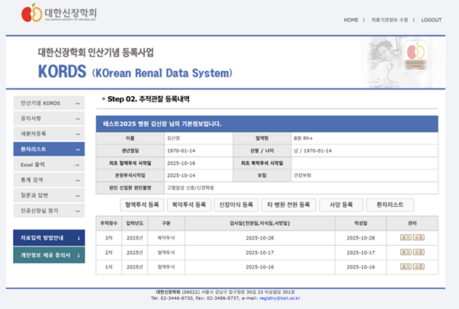
4. 오가노이드에서 관찰되는 사구체 여과 (Glomerular filtration)
시험관 속의 신장이라고 할 수 있는 오가노이드에는 상주 내피 세포가 있지만, 기능적 혈관이나 여과 가능 사구체를 형성하지는 않는다. 내피 세포는 사구체 기저막을 형성하기 위해 이러한 구조에서 족세포의 클러스터를 실질적으로 침범하지 않으며, 이러한 결함은 생체 내 인간 신장과 구조와 비교하면 명확하다. 따라서 체외에서 사구체 기능 무기질을 모니터링하는 능력은 아직까지 제한적이다. 대조적으로, 오가노이드가 생체 내에서 동물에 이식될 때, 족세포는 숙주 마우스 혈관과 함께 내부적으로 혈관화되어 내피 세포 주위에서 확장되고 평평해진다. 이들은 구조적으로 사구체와 유사하지만 미성숙하고 불확실한 기능적 특성을 가지고 있기 때문에 이를 "사구체 유사 구조"라고 부르는데, 이 구조의 내부에 있는 세포는 의 하위 집단은 인간 맥관 구조(Vasculature)의 마커들을 표지하여, 숙주가 아닌 이식편에서 유래한 것을 의미한다. 그러한 이식편의 사구체 유사 구조가 생체 내에서 기능하거나 여과할 수 있는 정도는 여전히 연구 중이다.
5. 오가노이드 세뇨관 내 물질(cargo)의 축적
인간 오가노이드에서 생리학적 분석 잘 정립된 방법중 하나는 형광 물질을 이용해 특정 분자가 축적되어 있는 것을 검사하는 것이다. 이러한 실험기법에서는 오가노이드의 배지에 일정기간 동안 형광물질을 첨가한 시기를 거쳐(pulse), 이 형광물질을 포함하지 않은 새로운 배지로 변경하게 되면 (chase), 형광 물질이 어떤 구조에 침착되어 있는 지를 확인할 수 있다. 형광 물질을 추적하여 어떤 구조에 침착되는 지를 추적하여 정보를 얻어낼 수 있다. 현재까지 테스트된 이동물질 (cargo)이 제한적이지만, 이를 통해 오가노이드가 생체 내에서 특히 신장에서 분리된 미세관을 부분적으로 모방하는 특이성을 보인다는 것을 입증하였다.
Dextrans
신장 오가노이드 세뇨관에서 일반적으로 다당류의 가지사슬인 덱스트란이 축적되는 경향이 있다는 것은 이미 입증되었다. 덱스트란은 상업적으로 구매가 가능하며, 분자량이 3-2,000 kDa) 로 다양하게 분포되어 있다. 10-kDa 덱스트란의 축적은 4시간 가량 오가노이드 배지에 첨가한 뒤 관찰하면 80%의 오르가노이드에서 관찰되며, 이 형광 신호는 24시간 이후에도 살아있는 배양물에서 눈으로 확인이 가능하다. 고정 후 면역 형광 분석을 해보면, 덱스트란은 특히 세뇨관관 내부의 정첨 표면에 가까운 유기질 근위 관[Lotus tetragonolobuslectin (LTL))에 축적된다. 액틴 중합을 억제하는 라트룬쿨린 B로 오르가노이드에 함께 처리하면 덱스트란 축적이 억제되어 이 과정이 활성 수송에 의존함을 알 수 있다. 오르가노이드는 4시간 배지에 첨가 후 추적하는 분석법에서 분자량이 최대 70 kDa까지 축적이 되는 것이 확인되었지만, 더 큰 분자량인 2,000 kDa 덱스트란은 축적되지 않음이 확인되었다.
Organic Anions
신장 오르가노이드는 배지에 특정 유기 음이온을 첨가하면, 오가노이드에 이를 축적할 수 있다. 덱스트란 축적과 비교할 때, 오가노이드에서의 유기 음이온 축적에 대한 연구는 아직 많이 진행되지 않았지만, 각각의 분자에 대해 따로 살펴보면, 분자량 949 Da(2)의 Methotrexate가 축적되는 것이 형광 염색을 통해 확인되었다. 형광염색을 한 Methotrexate 는 dextran과 유사하게 오가노이드 내에 축적되어 분포하였다가 24시간 이내 형광신호가 사라지게 된 것을 미루어볼 때, methotrexate는 detran에 비하여 그 축적이 dextran에 비해 가역적임을 확인할 수 있었다. 이와 같이, 특정 형광 분자를 축적하는 오가노이드의 능력이 입증되었으나, 향후 각각의 물질에 대한 오가노이드의 축적 및 유지 메커니즘에 대해서는 아직도 많은 연구가 필요하다.
향후 현 오가노이드 관련 연구에서의 제한점인 오가노이드에서의 관류(perfusion), 패턴화 및 성숙(maturation)은 향후 오가노이드의 연구에 있어 연구가 필요하다. 향후 오가노이드를 통한 기능적인 신장 역할의 대체, 소변의 생성 및 대체 가능한 인공장기로서의 발전 가능성을 위해서는 꾸준한 연구가 필요하다.
그림1 Physiology Assays in Human Organoids
(reference Am J Physiol Renal Physiol322: F625–F638, 2022)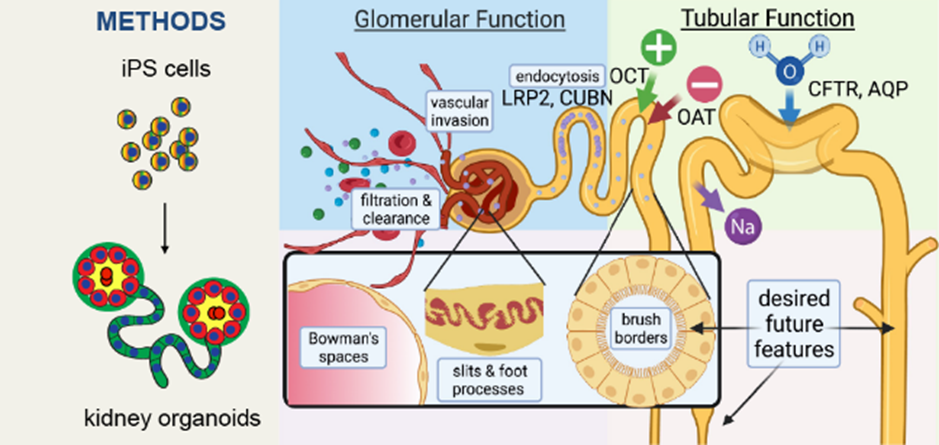
[ References ]
1. Am J Physiol Renal Physiol322: F625–F638, 2022.
2. Stem Cell Res. 2021 Mar;51:102215. doi: 10.1016/j.scr.2021.102215.
3. Cell Stem Cell14: 53–67, 2014. doi:10.1016/j.stem.2013.11.010
4. Nat Commun6: 8715, 2015. doi:10.1038/ncomms9715.3.
5. Stem Cells35: 2366–2378, 2017. doi:10.1002/stem.2707

[저작권자ⓒ 대한신장학회 소식지. 무단전재-재배포 금지]